- ホーム
- 二次元電気泳動のサンプル調製方法
二次元電気泳動のサンプル調製方法
サンプルの調製方法
抽出液の組成
尿素 0.42 g
チオ尿素 0.152 g
CHAPS 0.02 g
dithiothreitol (DTT) 0.0154 g
Pharmalyte pH3~10 25.0 µl
以上をMili-Q水で1.000 mlにメスアップする。
※ Pharmalyteが無い場合は入れなくても構いません。IPG Buffer、Bio-Lyteなどの両性担体も使用可能です。
論文などで報告されているサンプル抽出条件に合わせたい場合は、ご相談下さい。
陰イオン性の界面活性剤(SDSなど)は、等電点電気泳動の分離を低下させます。
ターゲットのタンパク質の可溶化に、陰イオン性の界面活性剤が必要な場合は、ご相談下さい。
実験動物などの組織の場合
1.組織を採取します。
2.組織を秤量し、その湿重量に対して5倍~10倍量の抽出液を加えます。
3.氷中で冷やしながら組織をすりつぶします。
4.遠心機(15,000rpm、20分、4℃)で遠心します。出来るだけ不純物は除去して下さい。
液面に大量の脂質が有る場合は、上清を採取し、再度、遠心を行って下さい。
5.上清を採取し、これを実験サンプルとします。ドライアイ冷凍状態で出荷下さい。
実験サンプルは10~54µlです。50~100µl以上をチューブなどに分注し、チューブ2~3本をドライアイ冷凍状態で送付下さい。
サンプル調製を依頼される場合は、採取した組織をドライアイ冷凍状態で送付下さい。サンプル調製に使用する組織は、50~100mgですが、サンプル量が少ない場合は、湿重量を測定下さい。

培養細胞の場合
1.浮遊した状態で培養された細胞の場合
5,000 rpmで5分間程遠心して細胞を集め、氷冷したPBSで再懸濁して遠心する形で3回洗浄して、
培地に由来するタンパク質を除きます。
接着して増える細胞の場合
培地を除いて、氷冷したPBSで2回容器内壁を洗浄し、氷上でプラスチッククレーパーなどを用いて細胞を掻き集めて、
5,000 rpmで5分間程遠心します。
2.できるだけPBSを除き、細胞重量を量ります。
3.細胞の湿重量に対して4倍量の抽出液を加えて、氷冷下で超音波破砕します。
4.遠心機(15,000rpm、20分、4℃)で遠心します。出来るだけ不純物は除去して下さい。
5.上清を採取し、これを試料とします。ドライアイ冷凍状態で送付下さい。
実験サンプルは10~54µlです。50~100µl以上をチューブなどに分注し、チューブ2~3本をドライアイ冷凍状態で送付下さい。
サンプル調製を依頼される場合は、PBSを除き細胞重量を測定したサンプルをドライアイ冷凍状態で送付下さい。

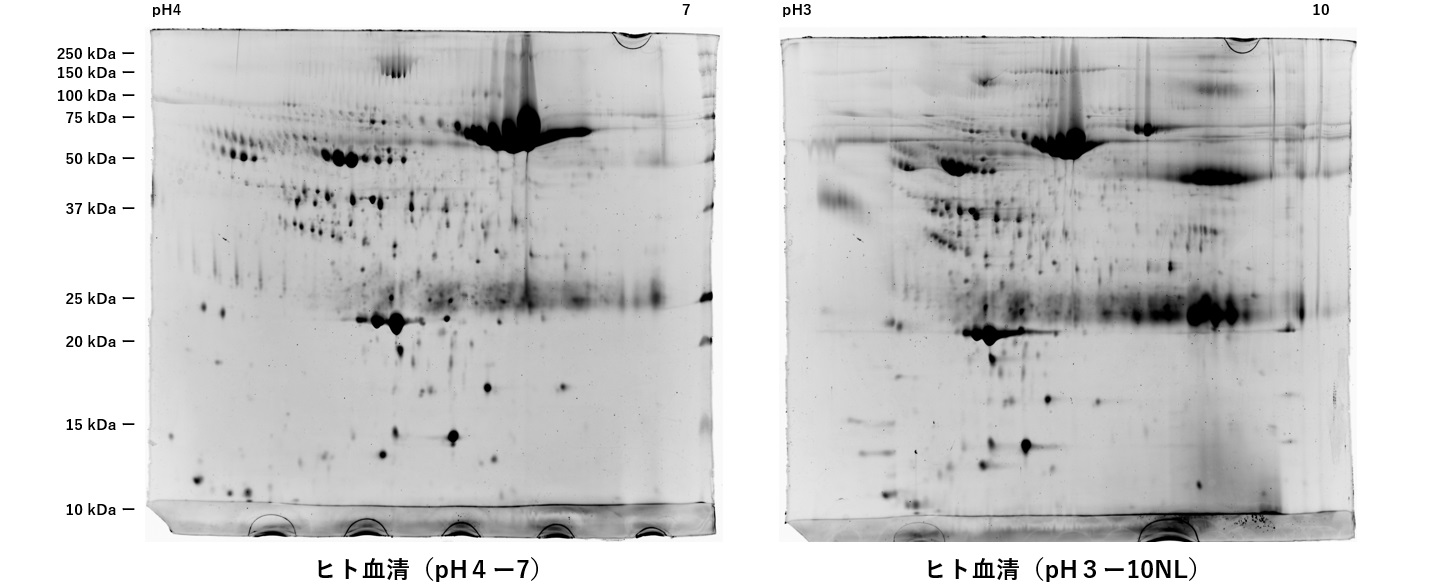
血清、血漿の場合
1.サンプルを分注し、等量の抽出液を加えて、氷冷下で超音波破砕します。
2.遠心機(15,000rpm、20分、4℃)で遠心します。出来るだけ不純物は除去して下さい。
3.上清を採取し、これを試料とします。ドライアイ冷凍状態で送付下さい。
実験サンプルは10~54µlです。50~100µl以上をチューブなどに分注し、チューブ2~3本をドライアイ冷凍状態で送付下さい。
サンプル調製を依頼される場合は、50µl以上に分注し、2~3本に分けてドライアイ冷凍状態で送付下さい。
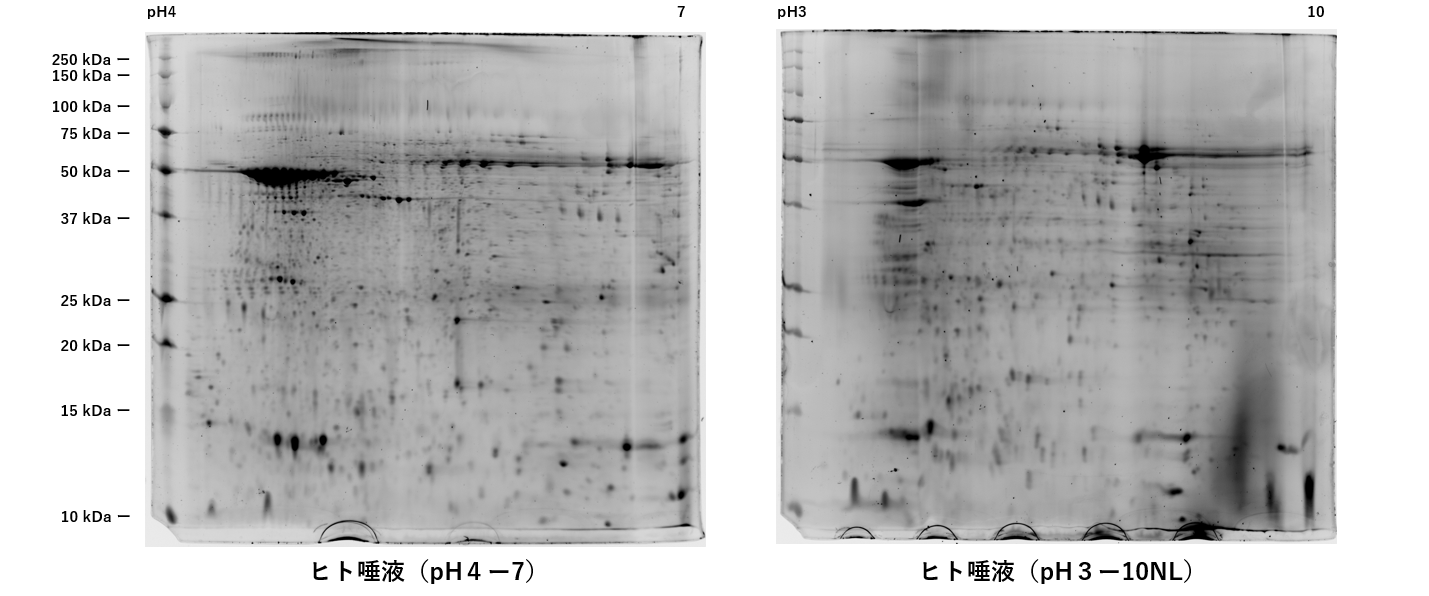
尿、唾液の場合
1.サンプルをアセトン沈殿処理します。
2.アセトンを取り除き、風乾後に50µlの抽出を加えてピペットで吸い吐きし可溶化します。
実験サンプルは全量です。チューブ2~3本分をドライアイ冷凍状態で送付下さい。
サンプル調製を依頼される場合は、100µl以上に分注し、2~3本に分けてドライアイ冷凍状態で送付下さい。
アセトンに可溶化したサンプルを送付頂き、サンプル調製を行う事も可能です。

植物組織の場合
1.組織を採取します。
2.組織を秤量後に乳鉢に入れて、湿重量の5~10倍の抽出液を加えます。
3.乳棒で組織をすり潰します。抽出液が足りない場合は追加します。
4.組織をすり潰した抽出液を回収し、遠心機(15,000rpm、20分、4℃)で遠心します。出来るだけ不純物は除去して下さい。
液面に大量の脂質が有る場合は、上清を採取し、再度、遠心を行って下さい。
5.上清を採取し、これを実験サンプルとします。ドライアイ冷凍状態で出荷下さい。
実験サンプルは10~54µlです。50~100µl以上をチューブなどに分注し、チューブ2~3本をドライアイ冷凍状態で送付下さい。
サンプル調製を依頼される場合は、採取した組織をドライアイ冷凍状態で送付下さい。

蛍光ラベル処理済みのサンプルの場合
蛍光ラベル処理を行ったサンプルによる二次元電気泳動も可能です。
下図は、タンパク質の硫黄化合物種のチオール基に、モノブロモビマン分子(mBBr)をラベル化したサンプルによる二次元電気泳動の画像データです。右図は、モノブロモビマン分子がラベル化されたスポットの画像データ、左図は、SYPRO Rubyで全スポットを検出した画像データです。詳細に関しましては、蛍光ラベルしたタンパク質のプロテオーム解析を参照下さい。
二次元電気泳動サンプルについて
サンプル中のタンパク質の濃度は、5.0~12.5ug/µlが理想です。
タンパク濃度が低い場合は、アセトン沈殿などの濃縮操作を検討して下さい。
タンパク濃度が高い場合は、希釈操作は当社で行います。
二次元電気泳動の抽出液には、高濃度の尿素、界面活性剤が含まれています。一部のタンパク定量試薬では、正確に測定できない場合が有りますので、お手持ちのタンパク定量試薬のマニュアルを、ご確認下さい。
サンプルのアプライ量は、最大54µlです。
サンプルは、室温にて融解後に試料塗付用ろ紙にアプライし、固定化勾配pHゲル上の塩基性側にセットし、等電点電気泳動を行います。
タンパク量で100~700µgのタンパク質をアプライします。サンプルに含まれる不純物が多い場合はアプライ量を少なく、また、微量なタンパク質のバイオマーカー探索、MS解析の同定結果を上げる場合はアプライ量を増やす事も可能です。実験の目的に合わせてアプライ量は、ご相談下さい。
サンプルの前処理に関して。
掲載している全ての画像データは、2-D Clean-Up Kit等の前処理は行っておりません。
サンプルの前処理にアセトン沈殿を行う場合が有りますが、タンパク質濃度が薄い、尿や涙などのタンパク質の濃縮が目的で行います。
また、塩濃度が高い薬剤にて刺激したサンプルに関しては、脱塩処理を検討下さい。
ご不明の点がございましたら、お気軽にご質問ください。


