- ホーム
- 蛍光ラベルしたタンパク質のプロテオーム解析
蛍光ラベルしたタンパク質のプロテオーム解析
硫黄化タンパク質のプロテオーム解析
硫黄化タンパク質のプロテオーム解析とは?
サルファーインデックス解析は、サンプル中の硫黄化合物を網羅的に解析する新しい技術です。
サルファーインデックス解析では、サンプル中の硫黄化合物種のチオール基(-SH)に、モノブロモビマン分子で特異的に化学修飾を行い、高速液体クロマトグラフ質量分析法(LC-MS/MS)を利用して、硫黄化合物種の分離・一斉検出が可能です。
モノブロモビマン分子には、2つの特徴が有ります。
1:モノブロモビマン分子は、タンパク質の硫黄化合物種のチオール基にラベル化されます。
2:モノブロモビマン分子は、蛍光検出が可能です。
この2つの特徴を利用して、二次元電気泳動実験を行いました。
硫黄化ラベルされたタンパク質の二次元電気泳動の画像データ
ラット血清を抽出液で可溶化し、その後、モノブロモビマン分子をラベル化処理しました。
二次元電気泳動の画像データから、モノブロモビマン分子(mBBr)のラベル化は、タンパク質の等電点には影響がなく、個々に分離したスポットを確認できました。pH4.5付近に、高分子から低分子まで縦にラインが検出されていますが、ラベル化されなかったモノブロモビマン分子が検出されています。
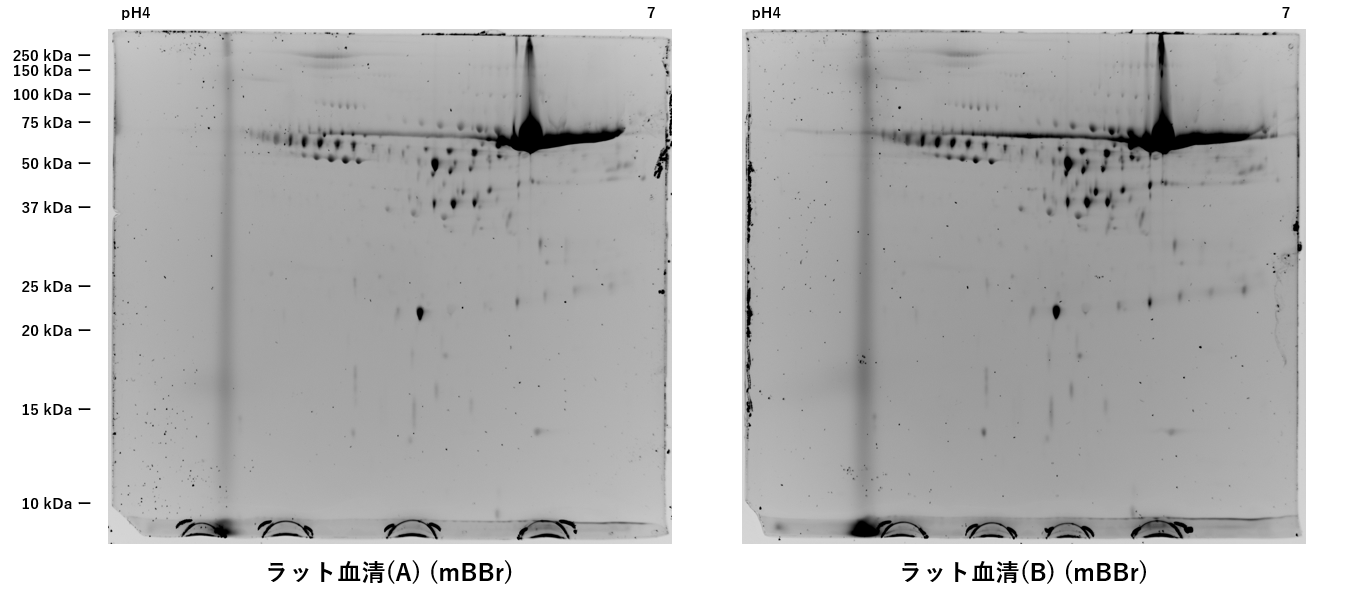
<撮影条件>
励起光源:UV(375nm)
検出側フィルター:440nmLP
撮影時間:15秒
モノブロモビマン分子の撮影後、二次元電気泳動ゲルをSYPRO Ruby染色し、全タンパク質のスポット検出を行いました。二次元電気泳動の画像データから、個々に分離したスポットが確認できました。また、pH4.5付近に検出された縦のラインは、SYPRO Ruby染色では検出されませんでした。

<撮影条件>
励起光源:BLUE LED(470nm)
検出側フィルター:580nmLP
撮影時間:15秒
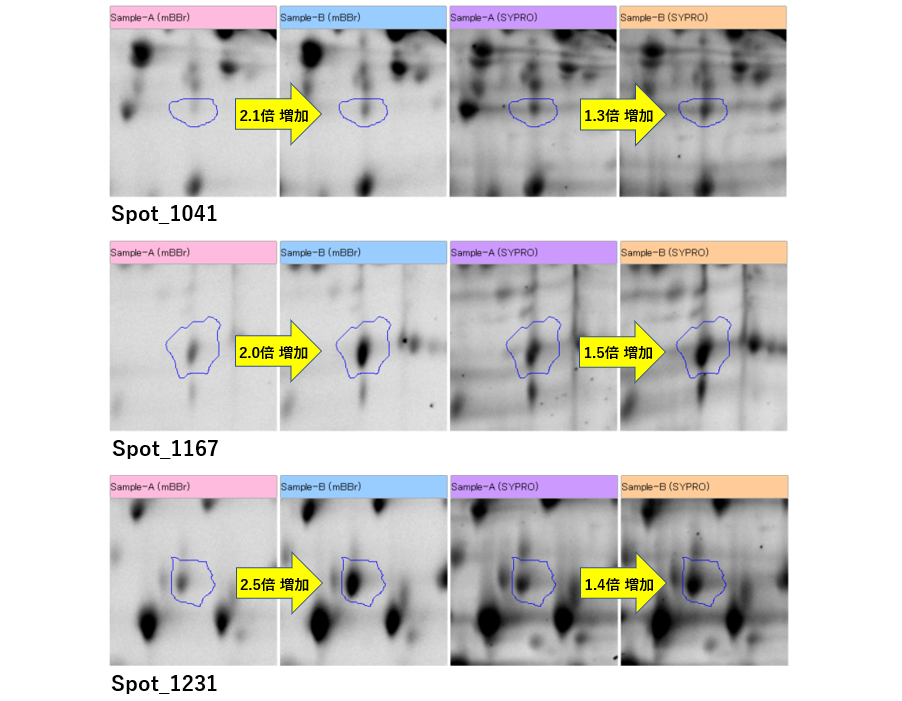
硫黄化ラベルされたスポットの変動解析
ラット血清(A)とラット血清(B)から検出したスポット群を、二次元電気泳動画僧解析ソフトウェア:SameSpots で比較解析を行いました。
モノブロモビマン分子(mBBr)でラベル化したスポット群を比較して、2倍以上変動しているスポット群は3個、1.5倍以上変動しているスポット群は27個でした。
下図は、2倍以上変動ている3個のスポット拡大画像です。左から、モノブロモビマン分子でラベル化したラット血清(A)(Sample-A)とラット血清(B)(Sample-B)の画像データ、SYPRO Rubyしたラット血清(A)(Sample-A)とラット血清(B)(Sample-B)の画像データになります。3つのスポットは、ラット血清(B)にて増加しているスポット群になります。
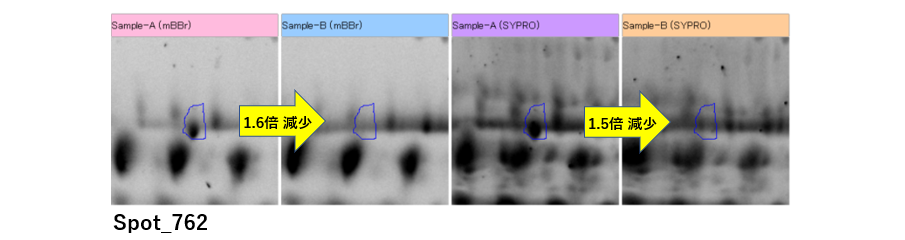
また、1.5倍以上変動しているスポット群の中にも、興味深いスポットが検出されています。Spot_762 は、バックグランドの影響で変動率は小さいですが、ラット血清(A)のみで検出されたスポットになります。
ラベル化サンプル と ノン・ラベル化サンプルの比較
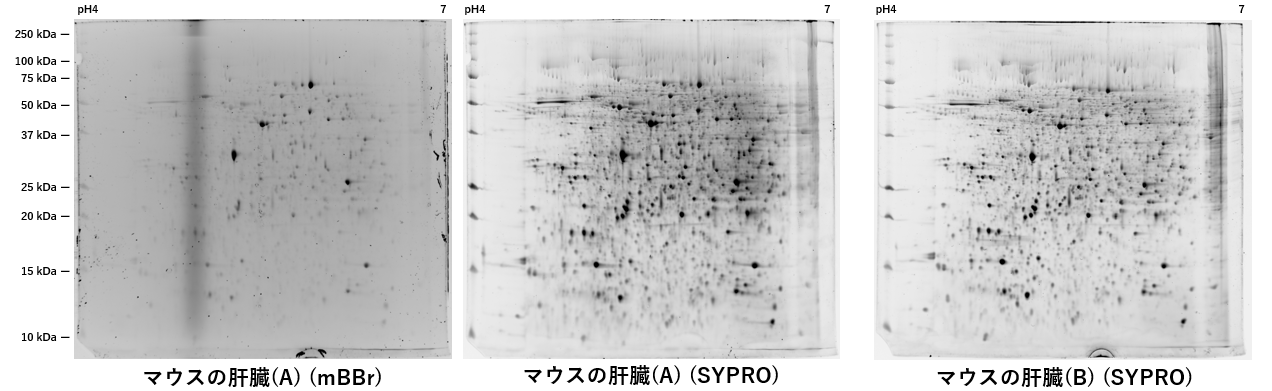
マウス肝臓を可溶化し、その後、モノブロモビマン分子のラベル化サンプル と ノン・ラベル化サンプルの二次元電気泳動を行いました。
マウスの肝臓(A)は、モノブロモビマン分子のラベル化サンプル、マウスの肝臓(B)は、モノブロモビマン分子のノン・ラベル化サンプルの二次元電気泳動画像になります。モノブロモビマン分子のラベル化サンプルは、タンパク質の等電点、MWに影響する事なく、綺麗に分離した二次元電気泳動の画像データが取得できる事が確認できました。
蛍光ラベルしたサンプルの二次元電気泳動に関して
モノブロモビマン分子でラベル化したサンプルに関して、綺麗に分離した二次元電気泳動の画像データを取得する事ができました。
同様に、蛍光ラベルしたサンプルに関して、二次元電気泳動の受託解析を行う事は可能です。また、SYRRO Ruby染色と併用して、全スポットも検出する事も可能です。お手持ちの蛍光ラベル化したサンプルが有りましたら、ぜひ、ご相談下さい。
ご不明の点がございましたら、お気軽にご質問ください。
